بیژن محمدی
دانشیار دانشکده مهندسی مکانیک – دانشگاه علم و صنعت ایران – تهران – ایران
bijanmohammadimaghaleh@iust.ac.ir
احسان عنبرزاده
دانشجوی مقطع دکتری مهندسی مکانیک – دانشگاه علم صنعت ایران – تهران – ایران
Ehsananbarzadeh74@gmail.com
علی عسگر ملک التجاری
دندانپزشک – شرکت درین کاشت مانا – تهران – ایران
aliasgarmalekaltejarimaghaleh@gmail.com
چکیده
روشهای جدید پر کردن جای خالی دندان، اقدام مهم و حائز اهمیتی میباشد. با پیشرفت علم و تکنولوژی، روشهای نوینی جایگزین استفاده از دندان به صورت مصنوعی شده است که این تکنیکها علاوه بر حفظ زیبایی دندان، جایگزین مناسبی برای رفع مشکلات دست دندانهای مصنوعی در گذشته میباشند. در واقع ايمپلنتهاي دنداني تثبيت کننده هايی هستند که به عنوان جايگزين براي ريشه ی دندان طبيعي از دست رفته استفاده ميشوند. استخوان اطراف ایمپلنت نقش کلیدي در حمایت و حفظ پایداری ایمپلنت دارد و از بین رفتن تدریجی آن موجب کاهش پایداری آن میشود. تا به امروز مطالعات زیادی در زمینه ایمپلنت دندان در عرصه های مختلفی اعم از: جراحی فک و دندان، بیومکانیک، بیومواد، ایمونولوژی و میکروبیولوژی، علوم اعصاب دندانی، مراقبتهای بعد از جراحی ایمپلنت و غیره انجام شده است. در این پژوهش، به بررسی ویژگیهای سیستم ایمپلنت 3A از دیدگاه ماکرو دیزاین و میکرو دیزاین و ویژگیهای آماده سازی سطح این ایمپلنت نیز پرداخته شده است. نهایتا به این نتیجه دست یافته شد که سرعت جذب ایمپلنت به استخوان در روش آماده سازی سطح SLActive نسبت به روش SLA برای ایمپلنت 3A، در بازه زمانی دو تا هشت هفته ای حدود 20 تا 22 درصد بیشتر میباشد.
واژگان كليدي: سیستم ایمپلنت، 3A، آماده سازی سطح
1- مقدمه
در طول سالها، انسان به دنبال راهی برای جایگزین کردن دندانهای از دست رفته بوده است. آثار به جا مانده نشان میدهد که از 700 سال پیش از میلاد، ساخت دندان شروع شده است و ابتدایی ترین آنها از جنس صدف بوده است. تا کنون دندانهایی از جنس چوب، طلا و کروم ساخته شده است(Yoo,2006). در حال حاظر ایمپلنتها را از جنس تیتانیوم و زیرکونیا میسازند. یک رویه بسیار مهم در بدن انسان ساخت استخوان جدید و یکپارچگی میباشد. یکپارچگی، یک مرحله ی پراهمیت در پروسه ی قرار دادن ایمپلنت دندانی میباشد، در حقیقت، بدن همان حالتی را تجربه میکند که در حال ترمیم یک استخوان شکسته باشد(Bozkaya,2014). یکپارچگی واکنش طبیعی بدن در برابر قرار دادن ایمپلنت میباشد. از ایمپلنتهای ابتدایی، ایمپلنتهای از جنس فولاد ضد زنگ را میتوان نام برد که با استخوان بدن سازگار بودند، اما یکپارچگی ایجاد نمیکردند. در نتیجه پس از مدتی به دلیل لق شدگی یا خوردگی و ساییدگی باید از بدن خارج میشد و کاربرد مطلوب را نداشتند. پس از آن یک پزشک سوئدی به نام برانمارک در طی آزمایشهای خود متوجه شد که فلز تیتانیوم زیست سازگار است و همچنین فاکتور مهم یکپارچگی را نیز دارد(Scott,2007). از جمله ویژگیهای ایمپلنتهای تیتانیومی؛ لق شدگی، خوردگی و زنگ زدگی بسیار پایین آن میباشد. اما مهمترین ویژگی آن، تحمل بار مکانیکی بالا است. در نتیجه این فلز و آلیاژهای آن را به عنوان گزینهای مناسب برای ساخت ایمپلنتهای دندانی، مفاصل ران و زانو که باید نیروهای فشاری زیادی را تحمل کنند تبدیل میکند. قسمت ثابت و رزوه دار ایمپلنت، همان قسمتی است که از جنس فلز تیتانیوم ساخته میشود. این قسمت درون فک قرار گرفته و برای جلوگیری از رشد بافت، بر روی ایمپلنت از پایه درمانی استفاده میشود. ابتدا ایمپلنت را در ناحیه ی بیدندان قرار میدهند(Hallman,2012). در صورتی که در اثر تصادف، ضربه و یا گذشتن مدت زیادی از کشیدن دندان، استخوان تحلیل رفته باشد؛ از پیوند استخوانی استفاده میشود و پس از 6 ماه اقدام به گذاشتن ایمپلنت میکنند(Mendonça,2008). پس از قرار دادن ایمپلنت در استخوان فک، با استخوان سازی سلولهای استخوان ساز در سطح ایمپلنت، استخوان فک به ایمپلنت جوش میخورد. فرایند جوش خوردن معمولا 3 تا 4 ماه طول میکشد. ایمپلنت در ایران، به تدریج از دهه ١٣۶٠ خورشیدی به علت احتیاج ایجاد شده پس از دوران جنگ تحمیلی و نیاز جانبازان و مجروحین برای جایگزینی دندانهای از دست رفته، رواج یافت و به دلیل استقبال از عملکرد آن، امروزه رشد و توسعه چشمگیر آن در مجامع پزشکی و علمی ایران دیده میشود(Shalabi,2006). این رشد فزاینده ناشی از این واقعیت است که بیماران به مرور پذیرفتهاند که با استفاده از ایمپلنتهاي دندانی، نه تنها دندانهاي از دست رفته، به بهترین وجهی جایگزین میشوند، بلکه مشکلاتی نظیر جویدن نامناسب، بدي تکلم و حتی عدم اعتماد به نفس که اکثرا در درمانهایی نظیر پروتز کامل یا پارسیل مشاهده میشود، به نحو مناسبی جبران میگردد(Anil,2011). از طرف دیگر میبایستی اذعان کرد که این رشد فزاینده براي قرار دادن ایمپلنت، باعث شده است که به مرور زمان بر تعداد دندان پزشکانی که تمایل به استفاده از این روش در کلینیک شخصی خود دارند، نیز افزوده شود. به طوری که در 20 سال گذشته، میزان درمانهاي ایمپلنت دندانی در سراسر دنیا به تعداد بیش از یک میلیون ایمپلنت در هر سال رسیده است(Rupp,2011). سازمانهاي متعدد دستورالعملهايي براي استاندارد سازي مواد به کار رفته در ساختار ايمپلنت ارائه نموده اند. عوامل متعددي ميتوانند بر يک درمان موفق با ايمپلنت دنداني تاثيرگذار باشند، از مهمترين اين عوامل ميتوان به تاثير طراحي هندسي ايمپلنت بر استحکام فصل مشترک ايمپلنت – استخوان و خواص مکانيکي نوع ماده به کار رفته در ساخت ايمپلنت اشاره کرد. همچنين امروزه پژوهشهاي بسياري در زمينهی بهبود خواص مکانيکي ايمپلنتهاي نانوساختار در حال انجام است. لازمه ی بررسي عوامل موثر در استحکام ايمپلنتها از ديدگاه طراحي هندسي و انتخاب مواد، شناخت ساختمان ايمپلنت و سيستمهاي بارگذاري در محيط دهان است(Wennerberg,2011). در همین راستا، شرکت درین کاشت مانا در کشور ایران، با هدف بهینه و بروز کردن و ارتقای کیفیت در زمینه تولید ایمپلنتهای دندانی شروع بکار نمود. نتیجه ی این تلاش تولید سه برند 3A و DPI و ARIO بوده که افتخاری برای کشور از نظر ایرانی بودن و کیفیت بالا و قابل رقابت بودن آن با برندهای مطرح دنیا و بینیاز نمودن کشور به واردات این متریال به لحاظ کمیت میباشد.
2- روش تحقيق
2-1- مدل ایمپلنت مورد نظر
به منظور بررسی ویژگیهای سیستم ایمپلنت 3A، ابتدا به شرح جزئیات ساختاری و طراحی این مدل ایمپلنت در این پژوهش، پرداخته شده است. تطابق کامل بخش کانکشن ایمپلنتهای 3A شرکت درین کاشت مانا، با بسیاری از برندهای موجود حال حاضر، امتیاز ویژه ای برای فیکسچرها و قطعات پروتزی محسوب میشود. در این نوع از فیکسچر، سه میلی متر کریستالی سیلندری شکل و تنه و قسمت اپیکالی، کاملا تِیپر میباشد و به لحاظ ماکرو دیزاین، فیکسچر را برای فک فوقانی بسیار مطلوب میسازد.
شکل (1)، ساختار و جزئیات اندازه گیری ابعاد مختلف این مدل از ایمپلنت را نمایش میدهد.
 |
 |
 |
| الف) | ب) | ج) |
| شکل (1): ایمپلنت 3A الف) فیکسچر ب) نمای برش خورده اتصال فیکسچر با اباتمنت ج) جزئیات اندازه های مدل ایمپلنت | ||
2-2- آماده سازی سطح ایمپلنت
فلز تیتانیوم از فلزات غیر گرانبها محسوب میشود و هزینه بالای آن به دلیل مراحل متعدد تولید از جمله آماده سازی سطح آن میباشد. ابتدا فلز تیتانیوم توسط حرارت دیدن به گرید مورد نظر رسیده و یا اینکه ابتدا آلیاژ آن تهیه میشود و سپس از آن مفتولهایی با قطرهای لازم ساخته شده که این قطرها به اندازه قطر ایمپلنتهایی است که باید تولید شوند(Mamalis,2011). بعد از این مرحله، مفتولهای ساخته شده به طولهای مورد نظر تقسیم میشوند که این، اندازه ی طول ایمپلنت دندانی را تعیین میکند. از این قسمت به بعد هزینه تولید ایمپلنت بالا میرود زیرا قطعات برش خورده باید تک به تک به ماشین CNC وصل شده و سطح خارجی و داخلی آن تراشیده شوند. در شکل (2)، دستگاه CNC مخصوص تراش ایمپلنت نشان داده شده است.
 |
 |
| شکل (2): دستگاه CNC مخصوص تراش ایمپلنت | |
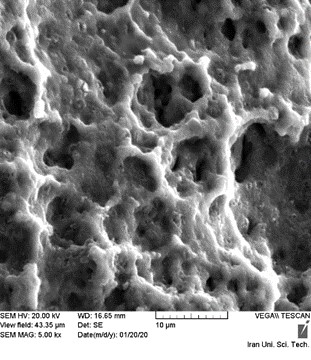
بعد از این مرحله به دلیل تقریبا صاف بودن سطح ایمپلنتها، باید سند بلاست شوند که برای این کار از اکسید آلومینیوم استفاده میشود. برای کیفیت بهتر، پودر مصرف شده از یک سو وارد مخزن سند بلاست شده و توسط ساکشن بعد از عملیات از سوی دیگر خارج میشود(Alfarsi,2014). ساختار و سطح انواع فیکسچر بر روی تعامل میان فلز و بافتهای زنده تاثیر گذار خواهد بود. یکی از دلایل اصلی برای تغییرات سطح ایمپلنتها، کاهش زمان جوش خوردن آنها میباشد. سطح فیکسچر، تنها قسمتی است که در تماس با محیط بیولوژیکی بدن (استخوان) بوده و مستقیما بر روی پاسخ استخوان تاثیر گذار میباشد. یک لایه سطحی خاص بر روی فیکسچر مورد نیاز است تا سطح عملکردی استخوان به فیکسچر را بالا برده و نهایتا استرس و نیروهای وارد شده به ایمپلنت بتوانند به سادگی به استخوان انتقال یابند(Schlegel,2013). این پوشش سطحی، باعث بالا رفتن رسوب استخوان بر روی ایمپلنت میشود که شامل تغییرات مکانیکی (ماشین کردن یا سند بلاست کردن)، تغییرات شیمیایی (اسید شویی کردن)، تغییرات الکتروشیمیایی (اکسیداسیون آندیک)، تغییرات خلاء (وکیوم)، درمانهای حرارتی و یا درمانهای لیزری میباشد. این تغییرات باعث کنترل رشد و فعالیتهای متابولیک سلولهای استخوانساز میشود. زبری سطح، باعث بالا رفتن(TGF-B) که یک هورمون رشدی است، خواهد شد و مستقیما باعث افزایش یکپارچه سازی میشود(Jinno,2004). شکل (3) نمونهای از سطح ایمپلنت سند بلاست شده را تا فکوس پنج هزار برابری نشان میدهد. از آنجایی که در درمان ایمپلنت دندان، شکلگیری استخوان قوی، بسیار حیاتی است؛ با این عملیات، تشکیل استخوان در خلل و فرج فیکسچ، بهتر صورت گرفته و فیکسچر به استخوان بیشتر جوش میخورد که همان طور که پیشتر اشاره گردید به این پدیده یکپارچگی گفته میشود. در یکپارچگی، درگیری به اندازهای زیاد است که تیتانیوم به استخوان کاملا جوش خورده به نظر میرسد؛ به طوری که بعد از زمان یکپارچگی فیکسچر به استخوان، حدود ۴۰۰ نیوتن نیرو لازم است تا ایمپلنتاز استخوان جدا شود. روشهای آماده سازی سطوح مختلفی برای افزایش جوش خوردن و یکپارچگی ایمپلنت به استخوان فک در دهه های گذشته مورد آزمایش قرار گرفته اند. از این میان به چند نمونه از معروفترین و کاربردیترین آنها در ادامه پرداخته شده است.

شکل (3): نمونهای از سطح ایمپلنت سند بلاست شده (Jinno,2004).
2-1- آماده سازی سطح ایمپلنت به روشهای SLA و SLActive
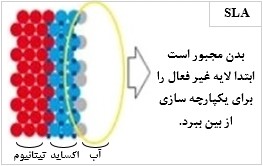
سطح 2A یا SLA برگرفته از عبارت Sand blasted Long grit Acid etched است که روشی برای سند بلاست کردن ایمپلنت میباشد. حرف S مخفف Sand blast که در اینجا به معنای پاشش ذرات آلومینا میباشد. حرف L مخفف Large grit به معنای دانه های درشت سند بلاست و حرف A مخفف Acid etched است که به معنای شست و شوی اسیدی میباشد. در این روش، تیتانیوم بعد از سند بلاست شدن، برای اسید شویی ارسال میشود. اسید شویی توسط اسید هیدروکلریک و اسید سولفوریک انجام میشود. نتیجه آن خشونت سطحی ایده آل و جوش خوردن بهتر فیکسچر به استخوان و از بین رفتن مواد بر روی سطح فیکسچر میباشد. در این مرحله، برای اینکه داخل فیکسچر آسیب نبیند، باید سطح داخلی آن توسط تفلون پوشانده شود که انجام این مرحله مستلزم صرف زمان و هزینه زیادی میباشد(Elkhaweldi,2014). در کنار این روش، روش دیگری به نام 3A یا SLActive که مختصر شدهی عبارت Sand blasted Long grit Acid etched Active میباشد، نیز وجود دارد. در روش آماده سازی سطح SLActive، با افزایش کانی سازی، به تشکیل استخوان سرعت بیشتری بخشیده میشود و اتصال استخوان با ایمپلنت، بهتر انجام میپذیرد. ایمپلنتهای دندانی با پوششهای سطحی SLA و SLActive به یک روش تولید میشوند. تنها تفاوت آنها در آخرین مرحله فرایند تولیدشان نهفته است. ایمپلنتهای SLA پس از سند بلاست و شست و شوی اسیدی یا اصطلاحا اچ کردن، خشک شده و آماده استفاده میباشند. در حالیکه ایمپلنتهایSLActive ، پس از اچ کردن، تحت شرایط محافظت گاز N2 و در محلول 9/0 درصد از NaCl (محلول نمکی) که ایزوتونیک است (به این معنی که نه باعث تورم سلولها میشود نه سبب چروکیدگی آنها)، ذخیره میشود(Lin,2011). نکته اساسی در بهبود ایمپلنت دندان، نحوه شکلگیری لخته خون بر روی ایمپلنت است. همان طور که در شکل (4)، نشان داده شده است؛ ویژگیهایی مانند فعالیت شیمیایی بالا و آبدوستی سطحSLActive ، سطح وسیعتری برای جذب پروتئین خون و ایجاد شبکه فیبرینی ایجاد میکند. این حالت ایدهآلترین وضعیت برای تشکیل لخته خون و شروع فرآیند بهبود است(Gangappa,2016). این تکنولوژی زمان شش تا هشت هفتهای بهبود در SLA را به سه تا چهار هفته کاهش میدهد. معمولا عدم موفقیت در ایمپلنت دندان، در مراحل اولیه بهبود، یعنی دو الی چهار هفته اول پس از کاشت ایمپلنت رخ میدهد. سطح SLActive همچنین میتواند در موارد ابتلا به پوکی استخوان، ترمیم استخوان و پیوند استخوان با فیکسچر را سرعت بخشد(Mangal,2011).
 |
 |
| الف) | ب) |
| شکل (4): آماده سازی سطح ایمپلنت به روش: الف) SLA و ب) SLActive ]56[ | |
سطح SLActive در مقایسه با سطوح معمولی آب گریز SLA ” اتصال استخوان با ایمپلنت (BIC) و چگالی استخوانی بیشتری را فراهم می کند. بعد از طراحی ایمپلنت (ماکرو دیزاین) که تاثیر زیادی در پرای مری استبیلیتی و ماندگاری و تقسیم نیرو های وارده و غیره دارد. و میکرو دیزاین و مدیریت اکسیداسیون سطح ایمپلنت سبب افزایش سطح تماس با استخوان و سریعتر و مداومتر و ماندگارتر شدن یکپارچگی و استقرار لایه محکم اکسید تیتانیوم میگردد. یکی از روشهای درمان سطح که طرفداران زیادی داشته و نتایج ان اثبات شده است، انجام روش SLA میباشد که سبب پروزیته زیاد در سطح ایمپلنت میگردد. همچنین انجام آنودایزینگ سطح، برای گسترده کردن اکسید تیتانیوم مورد علاقه، بر روی سطح ایمپلنت میباشد و همچنین این اواخر انجام روشهای SLActive که سبب اکتیو شدن سطح و هیدروفیلیسیتی و در نتیجه جذب سریع خون و ایجاد تماس با خون و تشکیل استخوان سریعتر میگردد، به جای روشهای معمولی مورد استفاده قرار میگیرد. در ابتدا مروری بر مزایای این دو روش، هدف از درمان سطح را بیشتر نمایان میسازد. تکنولوژی نوآورانهSLActive با اهداف ذیل طراحی شده است. ابتدا به خصوصیات هیدروفیلیسیتی سطح پرداخته میشود. به طور کلی تر شوندگی سطح می تواند روی چهار قسمت اصلی از سیستم بایولوژیکی بدن انسان تاثیر بگذارد(Hisbergues,2009).
- چسبندگی پروتئینها و مولکولهای بزرگ به سطح، فرایندی سریع است که در حد میلی ثانیه پس از قرار گیری ایمپلنت فعال میشود. در این مرحله پروتئینها و دیگر مولکولهای بزرگ چسبش به سطح را آغاز میکنند که میزان آن، تحت تاثیر ویژگیهای سطحی ماده مورد نظر است. ترشوندگی میتواند باعث جذب پروتئینها و یا هدایت بقیه عوامل و تحریک کنندهها به سطح شود. معمولا آبدوستی میتواند قدرت پیوند و میزان پروتئینهای چسبیده به سطح سازگاری و جهت دهی آنها را تحت تاثیر قرار دهد(Apratim,2015).
- تعامل سلولهای بافتی با سطح، نانو توپوگرافی سطح میتواند باعث تعدیل پاسخ سلولهای بافت نرم شود. این پاسخ ممکن است مختص به ساختار نانوی سطح و مستقل از بقیه موارد باشد. سطوح آبدوست توانایی افزایش 10 تا 20 درصدی سلولها را دارند(osyn,2012).
- چسبندگی باکتریایی یا عفونتهای مربوط به بایو مواد در موارد بسیار کمی دیده میشود، ولی در صورت بروز عفونت میتواند خطرهای جدی را در پی داشته باشد. باکتریهای آبگریز تمایل دارند که به مواد آبگریز بچسبند و به همین صورت باکتریهای آبدوست متمایلاند به سطوح آبدوست بچسبند. مطالعات نشان داده است که چسبندگی باکتریها به سطوح آبدوست تقریبا 90% کمتر از سطوح دیگر است(Meiller,2012).
- نرخ تجمیع استخوان در داخل بدن و اثر آبدوستی روی ایمپلنتهای تجاری با در نظر گرفتن تشدید استخوان سازی اولیه بسیار مهم است. در این حالت زمان درمان و زمان بازگشت بیماران به زندگی عادی، از چند ماه به چند هفته کاهش مییابد. سطوح آبدوست تشکیل استخوان بهتری را نسبت به سطوح آبگریز نشان میدهند. از این ویژگی میتوان برای افزایش موفقیت و کاهش زمان درمان برای سالمندان استفاده کرد. زیرا سطح آبدوست سطح تماس استخوان – ایمپلنت بسیار بیشتری را از خود نمایش میدهد(Esposito,2012).
- یکی از ویژگیهای سطح که بر قابلیتهای بایولوژیکی تاثیر میگذارد، قابلیت ترشوندگی سطح است که به انرژی سطح جسم مربوط میشود و برای اندازهگیری آن به صورت غیر مستقیم از اندازهگیری زاویه تماس استفاده میشود. سطوح آبدوست باعث افزایش چسبندگی، تکثیر و تقسیم سلولی میشوند و معدنی شدن استخوان را بهبود میبخشند؛ در حالی که سطوح آبگریز این ویژگی را ندارند. برای ایجاد زبریها با سایز میکرو، از فرایندهایی از جمله سند بلاست، اسید شویی و آنودایز استفاده میشود(Arora,2017).
سطح ايمپلنتهای محصولات تولیدی شرکت درین کاشت مانا تحت عنوان برندهای 3A / ARIO / DPI طی دو پروتکل کاملا مجزا از هم، به دو شکل SLA وSLActive انجام میشود. در توضیح روش اول سطح (SLA)، ابتدا با پارتیکول هایی از جنس های مختلف مثلا اکسید الومینیوم و یا اکسید تیتانیوم و یا مواد قابل حلی از نوع هیدروکسی اپاتاید و یا از ترکیبات سولفات و یا فسفات که با فشار های متناسب با خواست بر سطح تنه ایمپلنت پاشیده و سبب تخلل در سطح ایمپلنت میگردد. اندازه و عمق حفرهها بر روی سطح ایمپلنت متناسب با قطر و سختی پارتیکول سند بلاست و شدت و مقدار پاشش میباشد. در شرکت درین کاشت مانا از پارتیکولهای 150 میکرونی اکسید آلومینیوم با 5 بار فشار هوا توسط دو نازل بصورت اتوماتیک بر روی سطح ایمپلنت که با سرعت 50 دور در دقیقه به صورت محوری در حال چرخش میباشد با تایید تصاویر میکروسکوپ الکترونی و نمودار حاصله حفره هایی به تعداد 12 عدد در هر میلیمتر مربع به عمق متوسط 4 میکرون ایجاد میکند. که کاملا مطابق با استاندارد ایمپلنت های قرار گرفته در کاتگوری پروزیتههای متوسط نه خشن قرار میگیرد که بسیار ایده ال است. و با زبری سطوح ایمپلنتهایی با برندهای شناخته شده از جمله ITI مطابقت دارد. شکل (5) و (6)، به ترتیب نمایی از دستگاه سند بلاست و شست و شوی شرکت درین کاشت مانا را نمایش میدهد.
 |
 |
| شکل (5): نمایی از دستگاه سند بلاست کاملا اتوماتیک | |
یکی از موارد بسیار مهم و حیاتی در صورتی که از اکسید آلومینیوم جهت سندبلاست استفاده میگردد، تمیز کردن سطح ایمپلنت از ذرات و پارتیکولهای به جای مانده بر روی سطح از اکسید آلومینیوم میباشد که در شرکت درین کاشت مانا با استفاده از دستگاه شست و شوی اتوماتیک و استفاده از شست و شوی سرد و داغ، با ایجاد انبساط و انقباض بر روی سطح باقیماندههای اکسید آلومینیوم را کاملا تمیز مینماید.

شکل (6): دستگاه شست و شوی اتوماتیک با بازوهای اتوماتیک و بدون دخالت دست
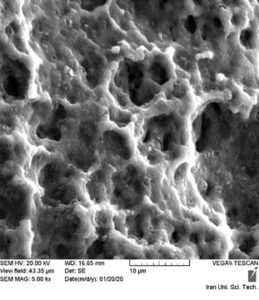
انجام عملیات اچینگ در دو مرحله ابتدایی توسط اسید HF به تناسب پاتند مربوطه که ضمن پاکسازی سطح و لایه برداری در حد میکرون است صورت میپذیرد. در آماده شدن سطح برای مراحل بعدی اچینگ، سطح ایمپلنت نیز از باقیماندههای احتمالی ذرات پارتیکلی اکسید آلومینیوم پاک سازی شده و بعد از این مرحله تست عکسبرداری از سطح ایمپلنت زیر میکروسکوپ الکترونی موید انجام میشود. یکی از اصلی ترین مرحله در درمان سطح لایه گستری اکسید بر روی سطح در دو مرحله است که مرحله اول آن با اسید موریاتیک با دمای 70 درجه میگیرد که میکرو پروزیتی بالایی را در سطح ایمپلنت ایجاد کرده و در مرحله بعدی توسط آنودایزینگ لایهایی به ضخامت 90 انگستروم اکسید بر روی تیتانیوم ایجاد مینماید که بسیار با ثبات میباشد. در شکل (7)، سطح ایمپلنت بعد از انجام عملیات سند بلاست توسط اکسید آلومینیوم نشان داده شده است. در نهایت امر، بسته بندی نهایی محصول ایمپلنت نیز صورت خواهد پذیرفت.
 |
 |
| الف) | ب) |
| شکل (7): سطح ایمپلنت بعد از انجام عملیات سند بلاست توسط اکسید آلومینیوم
الف) با دقت 500 برابر ب) با دقت 5000 برابر |
|
3- بحث و نتیجه گیری
سطح ایمپلنتهای SLA که بلافاصله بعد از قرار گرفتن در محیط اسید موریاتیک و بعد از آن در دستگاه آنودایزینگ آبدوست بودند، در مدت زمان کمتر از چند دقیقه تبدیل به سطح آبگریز میشوند. این در حالی است که سطح ایمپلنتهایSL3A شرکت درین کاشت مانا، بلافاصله بعد از قرار گرفتن در محیط اسید موریاتیک و دستگاه آنودایزینگ و تثبیت 90 انگسترومی اکسید تیتانیوم پایدار در سطح ایمپلنت، در محیط عاری از اکسیژن و زیر فشار گاز نیتروژن قرار داشته و تا انتهای مرحله بسته بندی و بعد از آن، تماس سطح ایمپلنت با اکسیژن و هوای آزاد قطع میگردد. این امر سبب میشود که علاوه بر عدم آلودگی سطح ایمپلنت با ذرات و پارتیکولهای هوا و کربن موجود در هوا، به هر اندازهایی هیدروفیلیستی سطح ایمپلنت تغییر نیابد و تا هر زمانی که ایمپلنت در داخل محلول اکتیواتور قرار دارد، هیدروفیلیسیته حفظ شود. خاصیت هیدروفیلیسیتی سطح ایمپلنتهای شرکت درین کاشت مانا سبب جذب املاح به صورت یکسان در تمام سطح و تمام پستی و بلندیهای روی سطح ایمپلنت میگردد. همچنین، پاکی سطح ایمپلنت که فاقد هر گونه ذرات کربن و باقیمانده و لاشه میکروبها در روی سطح میباشد؛ باعث میشود تا واکنش محکمی مابین اکسید تیتانیوم و املاح خون، شکل گرفته و استخوان سازی یکسانی بر روی تمام سطوح ایمپلنت ایجاد شود. ذرات کربن در تمام فضاهای دارای اکسیژن به صورت مخلوط موجود میباشد. حتی در فضای داخل کلین روم. یکی از مهمترین موارد در جذب سریع املاح و یونهای موجود در خون، هیدرو فیلیسیته بودن سطح ایمپلنت میباشد تا بتواند آب و املاح را به سمت خود جذب نماید و یا به عبارتی سطح آب دوست باشد. نشستن ذرات کربن بر روی سطح ایمپلنت، فضای مردهای روی سطح ایمپلنت ایجاد میکند که بعد از نشست، قابل تمیز کردن نیست. این فضاهای مرده مانع از اتصال سلولهای استخوانی بر روی سطح ایمپلنت میگردند و به عبارتی خاصیت زیستپذیری را کاهش میدهند؛ به طوری که در بعضی برندها این مقدار به 30% کل سطح ایمپلنت نیز میرسد. بنابراین غیر اکتیو بودن سطح ایمپلنت با مقادیر تماس استخوانی با ایمپلنت، رابطهایی مستقیم دارد. به همین علت در این پژوهش به جز بررسی نمونه SLA، از نمونهی SLActive که فعال میباشد، استفاده شده است. شکل (8)، درصد تمایل اتصال استخوان به ایمپلنت در هفتههای سپری شده پس از کارگذاری ایمپلنت در لثه بیمار، برای روشهای اشاره شدهی آماده سازی سطح ایمپلنت SLA) و (SLActive را نشان میدهد. همان طور که مشاهده میشود، سرعت جذب ایمپلنت به استخوان در روش SLActive نسبت به روش SLA در بازه زمانی دو تا هشت هفته حدود 20 تا 22 درصد بیشتر میباشد.

شکل (8): درصد تمایل اتصال استخوان به ایمپلنت در هفتههای سپری شده پس از کارگذاری ایمپلنت [56و58و60و61]
4- تشکر و قدردانی
بدینوسیله از شرکت تولید کننده ی سیستمهای ایمپلنت درین کاشت مانا به جهت در اختیار قرار دادن اطلاعات، امکانات و نمونه های ایمپلنتی در رابطه با اهداف این پژوهش به اینجانبان و همچنین بابت همکاری و مشاهده خط تولید ایمپلنت این شرکت، تشکر نموده و از عنایات و حسن لطف دست اندر کاران این شرکت بسیار سپاسگزار هستیم.
منابع و مراجع
Yoo, Roy H., et al. “Changes in crestal bone levels for immediately loaded implants.” International Journal of Oral & Maxillofacial Implants2 (2006).
Bozkaya, Dincer, Sinan Muftu, and Ali Muftu. “Evaluation of load transfer characteristics of five different implants in compact bone at different load levels by finite elements analysis.” The Journal of prosthetic dentistry6 (2004): 523-530.
Lee, Scott, et al. “Bone density assessments of dental implant sites: 3. Bone quality evaluation during osteotomy and implant placement.” International Journal of Oral & Maxillofacial Implants2 (2007).
Hallman, Mats, Lars Sennerby, and Stefan Lundgren. “A clinical and histologic evaluation of implant integration in the posterior maxilla after sinus floor augmentation with autogenous bone, bovine hydroxyapatite, or a 20: 80 mixture.” International Journal of Oral and Maxillofacial Implants5 (2002): 635-643.
Mendonça, Gustavo, et al. “Advancing dental implant surface technology–from micron-to nanotopography.” Biomaterials28 (2008): 3822-3835.
Shalabi, M. M., et al. “Implant surface roughness and bone healing: a systematic review.” Journal of dental research6 (2006): 496-500.
Anil, S., et al. “Dental implant surface enhancement and osseointegration.” Implant dentistry—a rapidly evolving practice(2011): 83-108.
Rupp, Frank, et al. “Wetting behavior of dental implants.” International Journal of Oral & Maxillofacial Implants6 (2011).
Wennerberg, Ann, Silvia Galli, and Tomas Albrektsson. “Current knowledge about the hydrophilic and nanostructured SLActive surface.” Clinical, cosmetic and investigational dentistry3 (2011): 59.
Mamalis, Anastasios A., and Spyridon S. Silvestros. “Analysis of osteoblastic gene expression in the early human mesenchymal cell response to a chemically modified implant surface: an in vitro study.” Clinical oral implants research5 (2011): 530-537.
Alfarsi, Mohammed A., Stephen M. Hamlet, and Saso Ivanovski. “Titanium surface hydrophilicity enhances platelet activation.” Dental materials journal(2014): 2013-221.
Schlegel, K. A., et al. “Osseointegration of SLA ctive implants in diabetic pigs.” Clinical oral implants research2 (2013): 128-134.
Elkhaweldi, A., et al. “The survival rate of RBM surface versus SLA surface in geometrically identical implant design.” J Oral Bio1 (2014): 8-15.
Jinno, Tetsuya, et al. “Effects of calcium ion implantation on osseointegration of surface-blasted titanium alloy femoral implants in a canine total hip arthroplasty model.” The Journal of arthroplasty1 (2004): 102-109.
Lin, Dong-Yang, and Xiao-Xiang Wang. “Preparation of hydroxyapatite coating on smooth implant surface by electrodeposition.” Ceramics International1 (2011): 403-406.
Gangappa, Rajkumar, et al. “Hydroxyapatite Biosynthesis by a Serratia sp. and Application of Nanoscale Bio-HA in the Recovery of Strontium and Europium.” Geomicrobiology Journal3-4 (2016): 267-273.
Roy, Mangal, Amit Bandyopadhyay, and Susmita Bose. “Induction plasma sprayed nano hydroxyapatite coatings on titanium for orthopaedic and dental implants.” Surface and Coatings Technology8-9 (2011): 2785-2792.
Hisbergues, Michael, Sophie Vendeville, and Philippe Vendeville. “Zirconia: Established facts and perspectives for a biomaterial in dental implantology.” Journal of Biomedical Materials Research Part B: Applied Biomaterials: An Official Journal of The Society for Biomaterials, The Japanese Society for Biomaterials, and The Australian Society for Biomaterials and the Korean Society for Biomaterials2 (2009): 519-529.
Apratim, Abhishek, et al. “Zirconia in dental implantology: A review.” Journal of International Society of Preventive & Community Dentistry3 (2015): 147.
C osyn, Jan, Nele Hooghe, and Hugo De Bruyn. “A systematic review on the frequency of advanced recession following single immediate implant treatment.” Journal of clinical periodontology6 (2012): 582-589.
Meiller, Timothy F., Karen Garber, and Mark Scheper. “A review of common oral pathology lesions, with a focus on periodontology and implantology.” Journal of Evidence Based Dental Practice3 (2012): 254-262.
Esposito, Marco, et al. “Interventions for replacing missing teeth: management of soft tissues for dental implants.” Cochrane database of systematic reviews2 (2012). D’Souza, Kathleen Manuela, and Meena Ajay Aras. “Types of implant surgical guides in dentistry: a review.” Journal of Oral Implantology5 (2012): 643-652.
Arora, H., and S. Ivanovski. “Melatonin as a pro‐osteogenic agent in oral implantology: a systematic review of histomorphometric outcomes in animals and quality evaluation using ARRIVE guidelines.” Journal of periodontal research2 (2017): 151-161.
Flanagan, Dennis, and Andrea Mascolo. “The mini dental implant in fixed and removable prosthetics: a review.” Journal of Oral Implantologysp1 (2011): 123-132.
Dard, M. “Methods and interpretation of performance studies for dental implants.” Biocompatibility and performance of medical devices. Woodhead Publishing, (2012). 308-344.
Chou, Hsuan-Yu, John J. Jagodnik, and S. Müftü. “Predictions of bone remodeling around dental implant systems.” Journal of Biomechanics6 (2008): 1365-1373.
Investigating the Features of 3A implant system from the macro and micro design perspective
| Ehsan Anbarzadeh
PhD student, Faculty of Mechanical Engineering, Iran University of Science and Technology, Tehran, Iran Ehsananbarzadeh74@gmail.com |
Bijan Mohammadi*Associate professor, Faculty of Mechanical Engineering, Iran University of Science and Technology, Tehran, Iran
bijanmohammadimaghaleh@iust.ac.ir |
| Ali Asgar Malek Altejari
Dentist, Dorin Kasht Mana Implant Company, Tehran, Iran aliasgarmalekaltejarimaghaleh@gmail.com |
|
Abstract
New methods of filling dental cavities are an important step. With the advancement of science and technology, new methods have replaced the use of artificial teeth, which in addition to maintaining the beauty of the teeth, these techniques are a good alternative to solve the problems of artificial teeth in the past. In fact, dental implants are stabilizers that are used as a replacement for the missing natural tooth root. The bone around the implant plays a key role in supporting and maintaining the stability of the implant, and its gradual loss reduces its stability. To date, many studies have been conducted in the field of dental implants in various fields, including: maxillofacial surgery, biomechanics, biomaterials, immunology and microbiology, dental neuroscience, post-implant surgery care, etc. In this research, the characteristics of 3A implant system from the perspective of macro design and micro design and the surface treatment characteristics of this implant have also been studied. Finally, it was concluded that the rate of implant adsorption to bone in the SLActive surface treatment method is about 20 to 22% higher than the SLA method in implant 3A over a period of two to eight weeks.
Keywords: Implant system, 3A, Surface treatment
گواهی مقاله اول